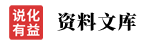常见漂白剂的漂白原理
 【特别提示】
【特别提示】
1.几种常见漂白剂的漂白原理比较
说明: SO2不能漂白酸碱指示剂,而氧化类漂白剂(如氯水、Na2O2)能漂白酸碱指示剂。
2.SO2的检验
(1)只含有SO2气体时的检验
方法一:把无色气体通入品红溶液,品红溶液褪色,含有SO2气体。
方法二:把无色有刺激性气味气体通入澄清石灰水产生白色沉淀,含有SO2气体。
(2)含有SO2和CO2的混合气体的检验
混合气体→品红溶液(褪色,有SO2)→酸性高锰酸钾溶液(变浅)→品红溶液(颜色不变,SO2被完全除去)→澄清的石灰水(变浑浊,有CO2)。
【现象和结论】
品红溶液褪色说明有SO2气体,通过高锰酸溶液时高锰酸钾溶液颜色变浅,再通过品红溶液时品红溶液颜色不变,说明SO2气体已经被完全除去,最后通过澄清石灰水变浑浊说明有CO2气体存在。
 【发散思维】常用来鉴别和分离SO2与CO2的装置
【发散思维】常用来鉴别和分离SO2与CO2的装置
上述装置中各部分的作用:
A.检验SO2的存在
B.除去SO2气体
C.检验SO2气体是否除去,并进一步吸收SO2
D.检验CO2气体并吸收
3.SO2与CO2的鉴别方法
叠加化学反应方程式的计算技巧
有些反应体系不只涉及一个反应,且不同的反应之间存在着某种联系,对于这样的反应体系,叠加化学反应方程式可使要解决的问题简便、明了。叠加化学反应方程式的关键是量的关系的衔接和确定,确定量的关系常用待定系数法,它的理论依据是质量守恒。
例1:用1 L 1.0mol/L的NaOH溶液吸收0.8 mol的SO2,所得溶液中的SO32-和HSO3-的物质的量的浓度之比最接近于( )
A.2:1 B.1:3 C.3:2 D.2:3
解析:
评注
:(1)若不用叠加方程式解题,则可根据SO2+2NaOH==Na2SO2+H2O和
SO2+NaOH==NaHSO3两个化学反应方程式,通过列方程组求解。
(2)常见的叠加反应还有:
 mCO2+nNaOH=xNa2CO3+yNaHCO3+zH2O
mCO2+nNaOH=xNa2CO3+yNaHCO3+zH2O
 mSO2+nBa(OH)2=xBaSO3↓+yBa(HSO3)2+zH2O
mSO2+nBa(OH)2=xBaSO3↓+yBa(HSO3)2+zH2O
 mCa(OH)2+nCO2==xCaCO3↓+yCa(HCO3)2+zH2O
mCa(OH)2+nCO2==xCaCO3↓+yCa(HCO3)2+zH2O
 mNa2CO3+nHCl==xHaHCO3+yCO2↑+zNaCl+wH2O
mNa2CO3+nHCl==xHaHCO3+yCO2↑+zNaCl+wH2O
例2:将适量的CO2通入含0.8g NaOH的碱溶液中,将产物在减压、低温下蒸干后得到1.37g固体物质。问:(1)产物是什么物质?(2)通入CO2的质量为多少?
解析:
评注
:(1)上述解法的前提是NaOH反应后无剩余。(2)若解得x=0,则表明只有NaHCO3这种生成物;若解得y=0,则表明只有Na2CO3这种种生成物;若x>0,y>0,则表明生成物中Na2CO3和NaHCO3均存在。
还有剩余内容未读